极化曲线及其测量方法
(1) 极化曲线
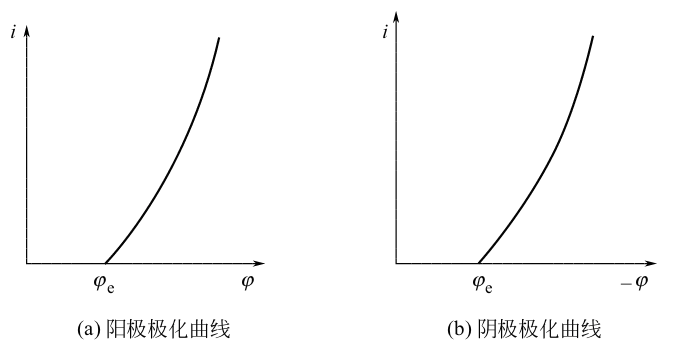
极化曲线是指电极在反应中的极化电势或过电势与通过的电流密度间的关系曲线,是研究电极反应规律最基本的方法之一。
i和中可以任一个为横坐标,另一个为纵坐标,可视需要及测量方法来定。
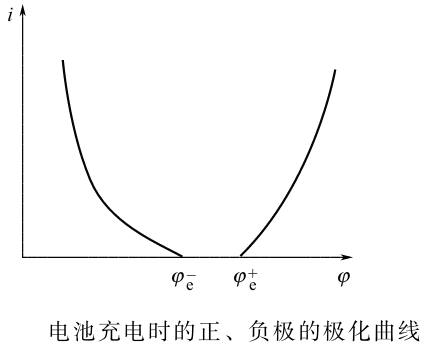
下图为阴阳极的极化曲线,注意这里不管对应的正极还是负极,其阴阳极都是如下图所示的。可以看出,随着放电电流增大,极化会逐渐增大。
由于存在极化电势,以及溶液、导线和接触点等的欧姆电势降(当电流通过时,相当于把的电能转化成热),故实际工作电压为:
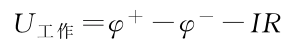
此时对于充电和放电过程是不一样的:
- 放电:电池放电时,端电压将下降。显然随着放电电流的增大,正负极上的极化增大,同时IR降也增大,因此导致电池的电压下降。即使维持放电电流不变,但随着放电时间的增加,正负极上活性物质的量将减少,极化将增大,电池的电压也会随时间的增加而下降。
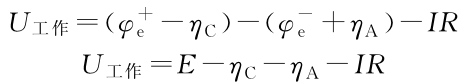
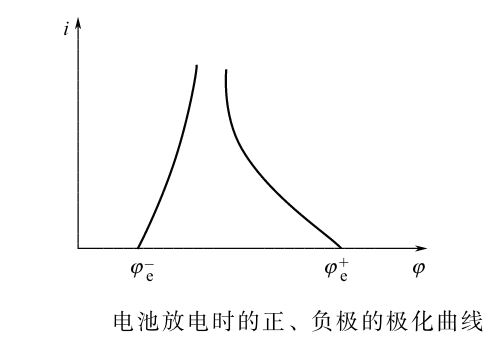
充电:正负极极化以及欧姆内阻均使电池电压升高。
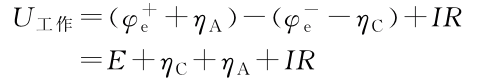
(2) 极化曲线的测量方法
目前一般采用三电极法,研究电极WE、辅助电极CE和参比电极RE。
RE的种类有很多,如标准氢电极、甘汞电极 (Hg∣Hg2Cl2∣KCl)、AgCl电极、(Ag∣AgCl∣Cl-)、Hg2SO4 电极 (Hg∣Hg2SO4∣SO42- )、HgO 电极 (Hg∣HgO∣OH- )
等,它们共同的特点是反应可逆性好,电势稳定。它们当中有的有成品出售,有的则可自行制作。
测量中关于RE的选择,原则上说是任意的,但需考虑被测体系电解液的组成及浓度等因素。一般应选择与被测体系电解液含有相同阴离子的参比电极,且两种电解液的浓度尽量接近。如HgO电极上的反应
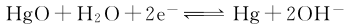
,电解液为KOH或NaOH。因此该参比电极适用于碱性体系中电势的测量,否则将产生液接电势,使测量误差加大。更重要的是若参比电极选择不当,将会给测量体系带来有影响的杂质,影响测量结果的准确性。
4. 电极过程特征及研究方法

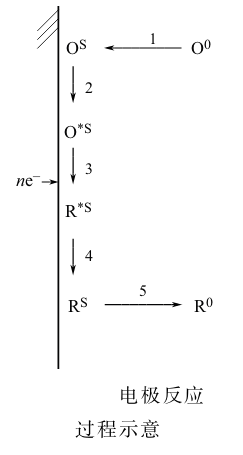
一个电化学反应的基本步骤 (又称单元步骤、分步步骤等)的类型如上图所示,但并非任一反应都有这五步。一般都有传质、电荷转移和液相传质或成相步骤,这三步是共同的。前置转化和随后转化则是某些反应有,某些反应没有。
此外,有时电极反应历程可能比上述过程还要复杂,比如除了有一系列串联的步骤之外,还可能有并联的基元反应。
外,还可能有并联的基元反应。
一个电极过程的各个基本步骤通常是串联进行的,因此各分步步骤的实际进行速率是相同的。但是,各基元步骤的绝对反应速率往往并不一样。绝对反应速率指的是假设某个基本步骤单独存在而无其他步骤时,以它自身反应能力所能达到的速率。只是当这些步骤同时存在,且串联进行,并当反应达到稳态时,各自的速率被迫地趋于一致。
这个实际速率只可能是取它们中最慢步骤的绝对反应速率。人们把绝对速率小,反应能力小的这个步骤称作 “慢”步骤。而把绝对速率大,潜在的反应能力大的步骤叫做 “快”步骤。整个反应只能按最慢步骤的速率进行,其余的 “快”步骤的反应能力实际上没有完全发挥出来。由于 “最慢”步骤控制了整个反应速率,而且整个反应表现出的特征正是这一步骤的特征,因此称之为速率控制步骤。
最慢步骤控制整个反应,而其他步骤则近似处于平衡状态。因此要研究一个电化学反应,应首先找出速率控制步骤。速率控制步骤的规律搞清了,整个反应的特征也就清楚了。
对于快步骤,它的平衡状态几乎没有被破坏,认为它们仍是可逆的,或叫准可逆。对于这样的步骤仍可用热力学方法去讨论、研究。如果电化学步骤是快步骤,能斯特方程就仍适用。
如果两个绝对速率较小的步骤,其速率相差不大时,反应就不可能单纯由一个步骤控制,而是由两个步骤共同控制,这种情况在电化学中一般叫做混合控制。另外,随着反应条件的变化,速率控制步骤是可以转化的。如当传质步骤为速率控制步骤时,可以增加搅拌强度,使传质速率加快,从而由慢步骤转变成快步骤。
总之,研究一个电化学反应通常的方法是:首先确定反应由哪些基本步骤组成,然后找出速率控制步骤,最后用动力学方法研究影响速率控制步骤的因素。

 中文
中文 英文
英文


 在线客服
在线客服